
-
お電話でのお問い合わせ03-6712-5985
- お問い合わせ
お電話でのお問い合わせ03-6712-5985

先発対後発両サイドの特許戦略に必要不可欠な知識や最近の話題をお届けする「医薬品特許戦略ブログ」を配信します。製薬関連企業の皆様はもちろん、アカデミアや投資家の皆様にも参考にしていただけるような、実践的なポイントをお届けしたいと思います。
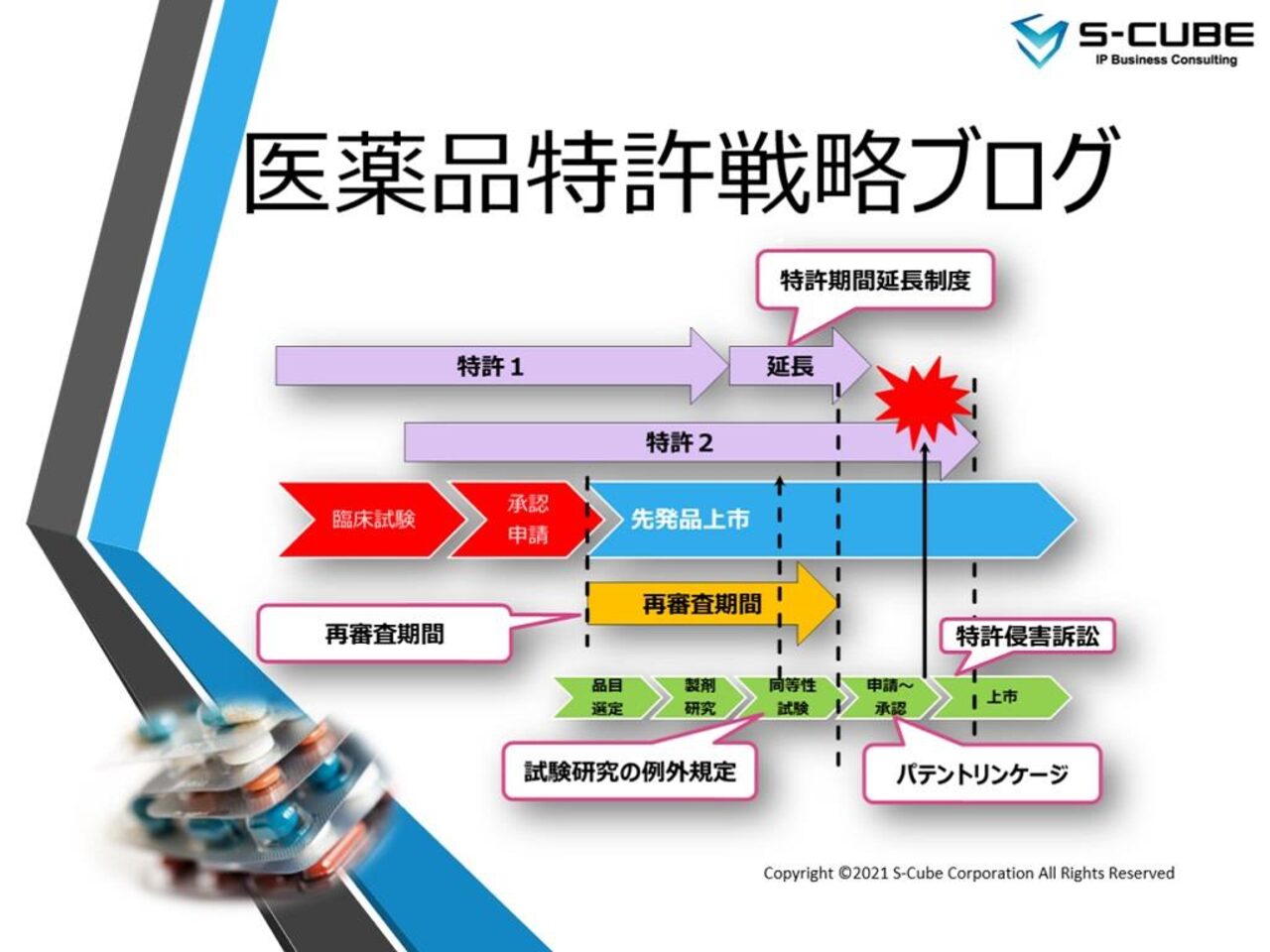
米国のパテントリンケージは、いわゆるハッチ・ワックスマン法(21 U.S.C.§505(j):Drug Price Competition and Patent Term Restoration Act.)で規定されている。
この法律は、新薬治験により浸食された特許期間の回復、後発医薬品申請の簡略化、後発医薬品の試験への試験研究の例外適用という問題を背景に、共和党のOrrin Hatch上院議員と民主党のHenry Waxman下院議員らにより起案され、先発企業と後発企業のバランスを取ることにより、全体として米国の医薬品産業の発展を促進することを立法趣旨として、1984年に制定された[15]。
このような背景から、ハッチ・ワックスマン法は、パテントリンケージのみならず、後発医薬品の簡易申請制度(ANDA:Abbreviated New Drug Application)、特許期間延長制度(35 U.S.C. §156)、試験研究の例外規定(35 U.S.C.§271(e)(1):ボーラー条項)について定めている。
尚、ハッチ・ワックスマン法で規定するパテントリンケージは、低分子医薬品を対象としている。バイオ医薬品については、BPCIA(生物製剤価格競争・イノベーション法)で規定するパテントリンケージ「パテントダンス」が適用される。
ANDAとは、Abbreviated New Drug Applicationの略であり、日本語にすると「後発医薬品の簡易申請」となる。日本語では、ANDA申請と表現されることもあるが(当ブログでも混在の可能性有)、ANDA申請=簡易申請申請ということになってしまう。
ANDAは、前述のハッチ・ワックスマン法で定められている。ハッチ・ワックスマン法以前は、後発医薬品であっても新薬と同様の臨床試験が必要とされていた。そのため後発医薬品のメリットは現状に比べるとはるかに小さかったものと思われる。
ANDA申請者は、申請にあたり、先発医薬品との生物学的同等性の証明、及びオレンジブック掲載の先発特許との関係について、パラグラフI~IVのいずれかの証明書を提出する必要がある。
パラグラフIまたはIIの証明書を伴う申請は、他の要件を満たせば承認される。パラグラフIIIの場合は特許満了後に承認される。
パラグラフIV証明書の場合は、申請者は提出から20日以内にNDA(新薬の承認)保持者及び特許権者に通知(Notice Letter)をする必要がある。ここからいわゆるANDA訴訟へと進む。
但し、ANDA申請者が承認を求めている適応症が、オレンジブックに掲載されている特許の使用方法(用途)とは異なる場合は、「セクションviiiステートメント」を提出(carve out)することができ、通知は要求されない(21 U.S.C. §355(j)(2)(A)(viii))。「carve out」は、日本でいう「虫食い申請」に相当すると考えてよいだろう。
(執筆者:田中康子)
脚注:[15]浅野俊彦「米国の医薬・バイオ関連分野におけるプロパテント政策の動向-ハッチ・ワックスマン法を中心に-」知財研紀要, 121~122(2006)
*************************************************************************
発行元 エスキューブ株式会社/国際特許事務所
〒105-0001 東京都港区虎ノ門5丁目12番8号 クローバー神谷町601
Tel 03-6712-5985 Fax 03-6712-5986
Email info@s-cubecorp.com
Website www.s-cubecorp.com
*************************************************************************
本ブログの無断転載はご遠慮下さい。
ブログの記載内容については正確を期しておりますが、弊所は、利用される方がこれらの情報を用いて行う一切の行為について責任を負うものではありません。